O=O = 499 kJ/mol dan H-O = 460 kJ/mol, maka entalpi reaksi pembentukan H2O2 adalah
H–H + O=O → H–O–O–H
| H–H | + | O=O | → | H–O–O–H | |
| +436 | +499 | +460+142+460 | |||
| +935 | – | +1062 | = –127 kJ | ||
Jika oksigen berlebihan, natrium dapat membentuk peroksida dengan reaksi:
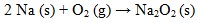
Pada elektrolisis larutan garam logam alkali tidak menghasilkan logam sebab:
- Harga Eo lebih kecil dari Eo air (+1,28)
- Ion logamnya tidak mengalami reduksi
Logam-logam alkali sangat stabil terhadap pemanasan, sehingga logam-logam alkali tidak dapat diperoleh dari oksidanya melalui proses pemanasan. Logam alkali tidak dapat dihasilkan dengan mereduksi oksidasinya,
hal ini disebabkan logam-logam alkali merupakan pereduksi yang kuat. Jika di elektrolisis dengan larutan garam maka yang menempel adalah airnya bukan logamnya dan akan membentuk basa alkali bukan logam alkali. sehingga yang dapat dielektrolisis adalah leburan garamnya.

0 komentar:
Posting Komentar