A. Simbol Titik Lewis
Pengembangan tabel periodik dan konfigurasi elektron memberi ahli kimia alasan untuk pembentukan molekul dan senyawa. Penjelasan ini dikonfigurasikan oleh Gilbert Lewis, ia mengatakan bahwa atom bergabung untuk mencapai konfigurasi elektron yang lebih stabil. Stabilitas maksimumterjadi ketika atom isoelektron dengan gas mulia. Ketika atom berinteraksi membentuk ikatan kimia, hanya sebagian luarnya saja yang bersentuhan. Karena alasan ini ketika kita mempelajari ikatan kimia, kita memperhatikan elektron valensi.Simbol titik lewis terdiri dari simbol unsur dan satu titik untuk setiap elektron valensi dalam atom unsur. Unsur dalam golongan yang sama memiliki konfigurasi elektron terluaar yang sama dan karenanya simbol lewis juga sama.
simbol titik lewis untuk representstif dan gas mulia
B. Ikatan Ionik
Pada ikatan ionik, terjadi transfer elektron dari atom satu ke atom yang lain. Oleh karena berpindahnya elektron, maka atom yang mendapatan elektron akan bermuatan negatif sedangkan atom yang kehilangan elektron akan menjadi positif.
ikatan ionik adalah gaya elektrostatik yang menyatukan ion dalam senywa ionik , misalnya reaksi antara litium dan fluor membentuk litiu florida. Konfigurasi elektron atom litium adalah 1s2 2s1 dan flourin adalah 1s2 2s2 2p5. Ketika atom litium dan flourin bersentuhan satusama lain, elektrin valensi 2s1 litium akan ditransfer ke atom flourin. dengan menggunakan simbol titik lewis, reaksinya bisa dipresentasikan seperti ini:
Untuk kenyamanan, bayangkan reaksi ini dalam langkah terpisah. Pertama ionisasi Li: Selanjutnya Flour : Selanjutnya, bayangkan dua ion terpisah bergabungmembentuk satuan senyawa LiF:
Jumlah ketiga persamaan ini adalah:
Ikatan ioni dala LiF adalah tarikan elektrostastik antara ion litium bermuatan positif dan ion flour bermuatan negatif. Maka senyawa itu akan netral secara muatan listrik.
C. Energi Kisi Senyawa Ionik
Energi kisi senyawa tidak dapat diukur secara langsung. Namun jika kitamengetahui struktur dan komposisi senyawa ionik, kita dapat menghitung energi kisi seyawa menggunakan hukum qoulomb, yang menyatakan bahwa energi potensial antara dua io berbanding lurus dengan produk muatannya dan berbanding terbalik dengan jarak pemisah diantara kedua muatannya.
kita juga dapat menentukan energi kisi secara tidak langsung dengan mengasumsikan bahwa pembentukan senyawa ionik terjadi dalam serangkaian langkah-langkah. Prosedur ini dikenal sebagai siklus Born-Haber, dimana menghubungkan energi kisi senyawa ionik dengan energi ionisasi, afinitas elektron, dan sifat-sifat atom dan molekul lainnya. Berikut contoh siklus born-heber:
siklus born-heber untuk pembentukan 1 mol LiF padat
tabel energi kisi dan titik lebur senyawa
D. Ikatan Kovalen
Ikatan Kovalen adalah ikatan yang terbentuk dari 2 elektroon yang diakai bersama oleh kedua atom H. Senyawa kovalen adalah senyawa yang hanya mengandung ikatan kovalen. Atom dapat membentuk berbagai jenis ikatan kovalen. Dalam 1 ikatan dua atom disatukan oleh satu pasangan elektron. Banyak senyawa disatukan oleh ikatan rangkap, ikatan rangkap ada 2 yaitu rangkap 2 dan 3.
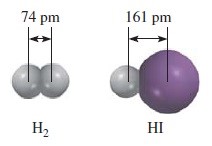
Panjang ikatan didefinisikan sebagai jarak antara inti kedua atom yang terikat secara kovalen dalam suatu molekul.
panjang ikatan (dalam pm H2 dan HI)
contoh beberapa panjang ikatan
E. Elektronegatifitas
Keelektronegatifan adalah hal yang relatif, yang berarti bahwa keelektronegatifan suatu unsur hanya dapat diukur dalam kaitannya dengan kelektronegatifan undur lain.
tabel keelektronegatifan unsur-unsur






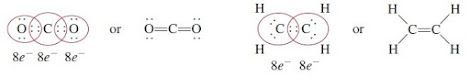




0 komentar:
Posting Komentar