Metalurgi dan Kimia Logam
A. Kejadian Logam
Sebagian besar logam berasal dari mineral. Mineral adalah zat yang terbentuk secara alami dengan berbagai komposisi kimia. Deposit mineral yang cukup terkonsentrasi untuk memungkinkan pemulihan ekonomis dari logam yang diinginkan dikenal sebagai bijih. Tabel 20.1 mencantumkan jenis mineral utama, dan Gambar 20.1 menunjukkan klasifikasi logam menurut mineral mereka.
Logam yang paling banyak, yang ada sebagai mineral di kerak bumi, adalah aluminium, besi, kalsium, magnesium, natrium, kalium, titanium, dan mangan (lihat hal. 52). Air laut adalah sumber yang kaya akan beberapa ion logam, termasuk Na1, Mg21, dan Ca21. Lebih jauh, area luas dari samudera ditutupi oleh nodul mangan, yang sebagian besar terdiri dari mangan, bersama dengan besi, nikel, tembaga, dan kobalt dalam keadaan gabungan kimia

B. Proses Metalurgi
Metalurgi adalah ilmu dan teknologi yang memisahkan logam dari bijihnya dan campuran logam campuran. Paduan adalah larutan padat baik dari dua atau lebih logam, atau dari logam atau logam dengan satu atau lebih bukan logam.
Persiapan Bijih
Dalam pengolahan awal bijih, mineral yang diinginkan dipisahkan dari bahan sisa biasanya tanah liat dan mineral silikat - yang secara kolektif disebut gangue. Salah satu metode yang sangat berguna untuk melakukan pemisahan seperti itu disebut flotasi. Pada proses ini bijih ditumbuk halus dan ditambahkan air yang mengandung minyak dan deterjen. Campuran cairan tersebut kemudian dikocok atau dikocok hingga membentuk buih. Minyak secara istimewa membasahi partikel mineral, yang kemudian terbawa ke atas dalam buih, sedangkan gangue mengendap ke bawah. Buih dibuang, dibiarkan runtuh, dan dikeringkan untuk memulihkan partikel mineralnya. Proses pemisahan fisik lainnya memanfaatkan sifat magnet dari mineral tertentu. Logam feromagnetik sangat tertarik pada magnet. Mineral magnetit (Fe, O,), khususnya, dapat dipisahkan dari gangue dengan menggunakan elektromagnet yang kuat. Cobalt adalah logam feromagnetik lainnya. Merkuri membentuk amalgam dengan sejumlah logam. Amalgam adalah paduan merkuri dengan logam atau logam lain. Oleh karena itu, merkuri dapat digunakan untuk mengekstraksi logam dari bijih. Merkuri melarutkan perak dan emas dalam bijih untuk membentuk amalgam cair, yang dengan mudah dipisahkan dari bijih yang tersisa. Emas atau perak diperoleh dengan menyuling merkuri.
Produksi Logam
Karena logam dalam bentuk gabungannya selalu memiliki bilangan oksidasi positif, produksi logam bebas adalah proses reduksi. Operasi pendahuluan mungkin diperlukan untuk mengubah bijih menjadi keadaan kimia yang lebih cocok untuk reduksi. Misalnya, bijih dapat dipanggang untuk menghilangkan pengotor yang mudah menguap dan pada saat yang sama untuk mengubah karbonat dan sulfida menjadi oksida yang sesuai, yang dapat direduksi dengan lebih mudah untuk menghasilkan logam murni:
Besi ada di kerak bumi di berbagai mineral, seperti iro pyrite(FeS2,), sider-ite (FeCO3,), hematit (Fe2O3), dan magnetit (Fe3O4). Dari jumlah tersebut, hematit dan magnetit sangat cocok untuk ekstraksi besi. Besi yang diekstraksi dengan cara ini mengandung banyak kotoran dan disebut besi kasar; mungkin mengandung hingga 5 persen karbon dan beberapa silikon, fosfor, mangan, dan belerang. Beberapa pengotor berasal dari mineral silikat dan fosfat, sedangkan karbon dan belerang berasal dari kokas. Besi kasar berbentuk butiran dan rapuh. Ia memiliki titik leleh yang relatif rendah (sekitar 1180 ° C), sehingga dapat dicetak dalam berbagai bentuk; untuk alasan ini disebut juga besi tuang.
Pembuatan Baja
Pabrik baja adalah salah satu industri logam terpenting. Di Amerika Serikat, konsumsi baja tahunan jauh di atas 100 juta ton. Baja adalah paduan besi yang mengandung 0,03 sampai 1,4 persen karbon ditambah berbagai unsur lainnya. Berbagai macam sifat mekanik berguna yang terkait dengan baja pada dasarnya merupakan fungsi komposisi kimia dan perlakuan panas dari jenis baja tertentu. Sedangkan produksi besi pada dasarnya adalah proses reduksi (mengubah oksida besi menjadi besi logam), konversi besi menjadi baja pada dasarnya adalah proses oksidasi di mana kotoran yang tidak diinginkan dikeluarkan dari besi melalui reaksi dengan gas oksigen. Salah satu dari beberapa metode yang digunakan dalam pembuatan baja adalah proses oksigen dasar. Karena kemudahan pengoperasian dan waktu yang relatif singkat (sekitar 20 menit) yang diperlukan untuk setiap konversi skala besar (ratusan ton), proses oksigen dasar sejauh ini merupakan cara paling umum untuk memproduksi baja saat ini. Gambar 21.4 menunjukkan proses oksigen dasar. Besi cair dari blast furnace dituangkan ke dalam bejana silinder tegak. Gas oksigen bertekanan dimasukkan ke dalam tabung berpendingin air di atas logam cair.
Pemurnian Logam
Logam yang dibuat dengan cara reduksi biasanya membutuhkan perawatan lebih lanjut untuk menghilangkan kotoran. Tingkat pemurnian, tentu saja, bergantung pada bagaimana logam tersebut akan digunakan. Tiga prosedur pemurnian umum adalah distilasi, elektrolisis, dan pemurnian zona.
Destilasi
Logam yang memiliki titik didih rendah, seperti merkuri, magnesium, dan seng, dapat dipisahkan dari logam lain dengan distilasi fraksional. Salah satu metode distilasi fraksional yang terkenal adalah proses Mond 'untuk pemurnian nikel. Gas karbon monoksida dilewatkan ke logam nikel yang tidak murni pada suhu sekitar 70 ° C untuk membentuk tetrakarbonilnikel yang mudah menguap yaitu zat yang sangat beracun.
Elektrolisis adalah teknik pemurnian penting lainnya. Logam tembaga yang diperoleh dengan memanggang tembaga sulfida biasanya mengandung pengotor seperti seng, besi, perak, dan emas. Logam yang lebih elektropositif dihilangkan dengan proses elektrolisis dimana tembaga tidak murni bertindak sebagai anoda dan tembaga murni bertindak sebagai katoda dalam larutan asam sulfat yang mengandung tembaga.
Metode lain yang sering digunakan untuk mendapatkan logam yang sangat murni adalah pemurnian zona. Dalam proses ini, batang logam yang mengandung sedikit kotoran ditarik melalui koil pemanas listrik yang melelehkan logam. Sebagian besar kotoran larut dalam logam cair. Saat batang logam keluar dari koil pemanas, ia mendingin dan logam murni mengkristal, meninggalkan kotoran di bagian logam cair yang masih ada di koil pemanas.
C. Teori Pita Konduktivitas Listrik
Konduktor
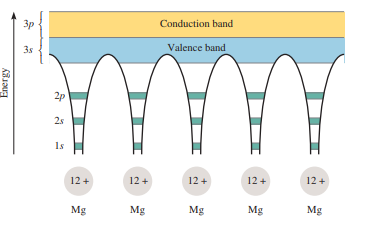
Gaya kohesif yang besar yang dihasilkan dari delokalisasi sebagian bertanggung jawab atas kekuatan yang tercatat di sebagian besar logam. Karena pita valensi dan pita konduksi berdekatan satu sama lain, jumlah energi yang dibutuhkan untuk mendorong elektron valensi ke konduksi dapat diabaikan. Di sana, elektron dapat bergerak bebas melalui logam, karena pita konduksi tidak memiliki elektron. Kebebasan bergerak ini menjelaskan fakta bahwa logam adalah konduktor yang baik, yaitu mampu menghantarkan arus listrik. Pada dasarnya, konduktivitas listrik suatu benda padat bergantung pada jarak dan status hunian pita energi. Dalam magnesium dan logam lainnya, pita valensi berdekatan dengan pita konstruksi, dan oleh karena itu, logam ini siap bertindak sebagai konduktor. Sebaliknya, pada kayu dan kaca, jarak antara pita valensi dan pita konduksi jauh lebih besar daripada di logam. Akibatnya, lebih banyak energi yang dibutuhkan untuk mengeluarkan elektron ke pita konduksi. Karena kekurangan energi ini, elektron tidak dapat bergerak bebas. Oleh karena itu, kaca dan kayu adalah isolator, konduktor listrik yang tidak efektif
Semikonduktor
Sejumlah elemen adalah semikonduktor yaitu akan menghantarkan listrik pada suhu tinggi atau bila digabungkan dengan sejumlah kecil elemen tertentu lainnya. Unsur-unsur silikon dan germanium Golongan 4A secara khusus cocok untuk tujuan ini. Kemampuan semikonduktor untuk menghantarkan listrik dapat ditingkatkan dengan menambahkan sejumlah kecil pengotor tertentu ke elemen, proses yang disebut doping. Saat ini semikonduktor merupakan komponen penting dari hampir semua peralatan elektronik, mulai dari radio dan televisi hingga kalkulator saku dan komputer. Salah satu keunggulan utama perangkat solid-state dibandingkan elektronik tabung vakum adalah bahwa yang pertama dapat dibuat pada satu "chip" silikon yang tidak lebih besar dari penampang penghapus pensil. Akibatnya, lebih banyak peralatan dapat dikemas ke dalam volume kecil - titik yang sangat penting dalam perjalanan luar angkasa, serta dalam kalkulator genggam dan mikroprosesor (komputer dengan chip).
D. Kecendrungan Periodik Sifat Logam
logam berkilau dalam penampilan, padat pada suhu kamar (dengan pengecualian merkuri), konduktor panas dan listrik yang baik, mudah dibentuk (dapat ditempa pada saat itu), dan ulet (dapat ditarik ke dalam kawat).Seperti yang kita lihat pada Gambar 9.5, elektronegativitas elemen meningkat dari kiri ke kanan melintasi suatu periode dan dari bawah ke atas dalam sebuah kelompok. Karakter logam dari logam meningkat hanya di arah yang berlawanan, yaitu, dari kanan ke kiri melintasi suatu periode dan dari atas ke bawah dalam suatu kelompok. Karena logam umumnya memiliki keelektronegatifan yang rendah, mereka cenderung membentuk kation dan hampir selalu memiliki bilangan oksidasi positif dalam senyawanya. Namun, berilium dan magnesium dalam Grup 2A dan logam dalam Grup 3A dan selanjutnya juga membentuk senyawa kovalen.
E. Logam Alkali
Sebagai sebuah gugus, logam alkali (unsur Golongan IA) adalah unsur yang paling elektropositif (atau paling sedikit elektronegatif) yang diketahui. Dari konfigurasi elektronnya kita perkirakan bilangan oksidasi unsur-unsur ini dalam senyawanya adalah +1 karena kationnya akan isoelektronik dengan gas mulia. Ini memang masalahnya. Logam alkali memiliki titik leleh rendah dan cukup lunak untuk diiris dengan pisau . Semua logam ini memiliki struktur kristal berpusat tubuh dengan efisiensi pengemasan yang rendah. Ini menjelaskan kepadatan rendah mereka di antara logam. Faktanya, lithium adalah logam paling ringan yang diketahui. Karena reaktivitas kimianya yang besar, logam alkali tidak pernah terbentuk secara alami dalam bentuk unsur; mereka ditemukan dikombinasikan dengan ion halida, sulfat, karbonat, dan silikat. Pada bagian ini kami akan menjelaskan kimiawi dua anggota Kelompok IA-natrium dan kalium.Sifat kimiawi litium, rubidium, dan sesium kurang penting; semua isotop fransium, anggota terakhir grup, adalah radioaktif Natrium dan kalium hampir sama melimpah di alam. Mereka terjadi pada mineral silikat seperti albite dan ortoklas. Selama periode waktu yang lama (dalam skala geologi), mineral silikat perlahan-lahan terurai oleh angin dan hujan, dan ion natrium dan kaliumnya diubah menjadi senyawa yang lebih larut. Akhirnya hujan melepaskan senyawa ini dari tanah dan membawanya ke laut. Namun ketika kita melihat komposisi air laut, kita menemukan bahwa rasio konsentrasi natrium terhadap kalium adalah sekitar 28 berbanding 1. Alasan untuk distribusi yang tidak merata ini adalah karena kalium penting untuk pertumbuhan tanaman, sedangkan natrium tidak. Tumbuhan mengambil banyak ion kalium di sepanjang jalan, sementara ion natrium bebas bergerak ke laut.
F. Logam Alkali Tanah
Logam alkali tanah agak kurang elektropositif dan kurang reaktif dibandingkan logam alkali. Kecuali untuk anggota keluarga pertama, berilium, yang menyerupai aluminium (logam Grup 3A) dalam beberapa hal, logam alkali tanah memiliki sifat kimia yang serupa. Karena ion M21 mereka mencapai konfigurasi elektron yang stabil dari gas mulia sebelumnya, jumlah oksidasi logam alkali tanah dalam bentuk gabungan hampir selalu 12. Tabel 20.5 mencantumkan beberapa sifat umum dari logam ini. Radium tidak termasuk dalam tabel karena semua isotop radium adalah radioaktif dan sulit dan mahal untuk mempelajari kimia unsur Grup 2A ini
Magnesium
Magnesium adalah unsur paling banyak keenam di kerak bumi (sekitar 2,5 persen massa). Air laut merupakan sumber magnesium yang baik; ada sekitar 1,3 g magnesium dalam setiap kilogram air laut. Seperti halnya dengan kebanyakan logam alkali dan alkali tanah, magnesium logam diperoleh dengan elektrolisis, dalam hal ini dari MgCl lelehnya.Magnesium Magnesium adalah unsur paling banyak keenam di kerak bumi (sekitar 2,5 persen massa). Di antara bijih magnesium utama adalah brucite, Mg (OH) ;dolomit, CaCO, · MgCO,dan epsomite, MgSO, 7H, 0. Air laut merupakan sumber magnesium yang baik; ada sekitar 1,3 g magnesium dalam setiap kilogram air laut. Seperti halnya dengan kebanyakan logam alkali dan alkali tanah, magnesium logam diperoleh dengan elektrolisis, dalam hal ini dari MgCl lelehnya .
Kalsium
Kerak bumi mengandung sekitar 3,4 persen kalsium berdasarkan massa. Kalsium terdapat dalam batu kapur, kalsit, kapur, dan marmer sebagai CaCO ,; dalam dolomit sebagai CaCO, · MGCO, (lihat Gambar 21.15); dalam gypsum sebagai CaSO, · 2H, 0; dan di fluorit sebagai CaF; (Gambar 21.16). Kalsium logam paling baik dibuat dengan klektrolisis kalsium klorida cair (CaCl,). Saat kami membaca Grup 2A dari berilium menjadi barium, kami mencatat peningkatan sifat logam. Tidak seperti berilium dan magnesium, kalsium (seperti strontium dan barium) bereaksi dengan air dingin untuk menghasilkan hidroksida yang sesuai, meskipun laju reaksinya jauh lebih lambat daripada yang melibatkan logam alkali. Kalsium logam memiliki kegunaan yang agak terbatas. Ini berfungsi terutama sebagai agen paduan untuk logam seperti aluminium dan tembaga dan dalam persiapan logam berilium dari senyawanya. Ini juga digunakan sebagai agen dehidrasi untuk pelarut organik. Kalsium merupakan elemen penting dalam materi hidup. Kalsium logam memiliki kegunaan yang agak terbatas. Ini berfungsi terutama sebagai agen paduan untuk logam seperti aluminium dan tembaga dan dalam persiapan logam berilium dari senyawanya. Ini juga digunakan sebagai agen dehidrasi untuk pelarut organik. Kalsium merupakan elemen penting dalam materi hidup
G. Aluminium
Aluminium adalah logam yang paling berlimpah dan unsur paling berlimpah ketiga di kerak bumi (7,5 persen massa). Bentuk unsur tidak terjadi di alam; bijih utamanya adalah bauksit. Mineral lain yang mengandung aluminium adalah orthoclase, beryl, cryolite, dan korundum
Aluminium adalah salah satu logam paling serbaguna yang dikenal. Ini memiliki kepadatan rendah (2,7 g / cm ') dan kekuatan tarik tinggi (yaitu, dapat diregangkan atau ditarik keluar). Aluminium mudah dibentuk, dapat digulung menjadi foil tipis, dan merupakan konduktor listrik yang sangat baik. Konduktivitasnya sekitar 65 persen dari tembaga. Namun, karena aluminium lebih murah dan lebih ringan daripada tembaga, aluminium banyak digunakan pada saluran transmisi tegangan tinggi. Meskipun aluminium paling banyak digunakan dalam konstruksi pesawat terbang, logam murni itu sendiri terlalu lunak dan lemah untuk menahan banyak tekanan. Sifat mekanisnya sangat ditingkatkan dengan memadukannya dengan sejumlah kecil logam seperti tembaga, magnesium, dan mangan, serta silikon. Aluminium tidak digunakan oleh sistem kehidupan dan umumnya dianggap tidak beracun. Saat kita membaca tabel periodik dari kiri ke kanan dalam periode tertentu, kita mencatat penurunan bertahap dalam sifat logam. Jadi, meskipun aluminium dianggap sebagai logam aktif, aluminium tidak bereaksi dengan air seperti halnya natrium dan kalsium.

















0 komentar:
Posting Komentar